��H�A�g�@���ʃC���^�r���[
�u��Ë@��̐\�����珳�F�܂ł��C���ĕ��݂́g14�����h�Ɂv
�|�c��ȏ��i�_���������悭�R������d�g�݂ŁC���ۋ����͌����ڎw���|�p�D�܂��C��Ë@��R���̓����ƁC�R���̌���ɂ��ċ����Ă��������B
�܂����i�Ƃ͈Ⴄ�C��Ë@��Ȃ�ł͂̓����Ƃ��āC�g���ɃA�C�e�����������h�C�Ƃ������Ƃ������܂��B�a�@�ł̐f�f�E���Â̗���Ɏv�������ׂ�ƕ�����悤�ɁC�܂��ǂ�ȕa�C�E���䂩��m�邽�߂̐f�f������C���u���s�����߂̎��Ê����p�̂��߂̊�����܂��B�ŋ߂ł́C�y�ǂ̕a�C�E����ł���ꍇ�ɂ́C�Đ���Â�g�D�H�w��K�p���܂����C���Ɋւ��悤�ȏꍇ�ɂ́C����⍜�E�g�D�E�畆�Ȃǂ�l�H����C�l�H�ޗ��Œu��������C�Ƃ������Ƃ��s���܂��B
���̂悤�ɁC���҂ɐG��Ȃ��Ŏg�����̂���C�̓��ɖ��ߍ��ނ��̂܂ŁC��Ë@��͎�ނ����ɑ����o���G�e�B�ɕx��ł���̂ł��B���̓��e���傫��MRI���p�p���{�b�g�Ȃǂ���CX���t�B�����C�J�e�[�e���C��p�p���Ɏ���܂ł��܂��܂ŁC��ނ͂Ȃ��4000��ȏ�ƌ����܂��B
���������C�܂�Łu�@�B�̃f�p�[�g�v�̂悤�ȗ̈��R�����Ȃ���Ȃ�Ȃ��킯�ł�����C�R�����e�Ղł͂���܂���B���Ƃ��Ƃ͌����J���Ȃ̉��ɁC���i��Ë@��R���Z���^�[�y�сi���j��Ë@��Z���^�[������v20�l�]��ŁC��Ë@��g�N��3000���h�Ƃ����c��ȐR�������Ȃ��ɂ͐l��s���ł����B
����ŁC��Ë@��̊J������Տ������C���F�Ɏ���܂ł̎��Ԃ��C�O�ɔ�ׂĒ�������Ƃ��������́C���{�̈�Ë@��Y�Ƃ̍��ۋ����͂����킹��傫�ȗv���Ƃ��Ȃ��Ă��܂��B���E�I�ɑ傫�ȃV�F�A�������Ă݂̂Ȃ炸�C��ʂɂ���Ă̓A�W�A���̋}���Ȓǂ��グ�̒��ŁC�u���{�̐R�����x���v�Ƃ�������͈ꍏ�������Ŕj���Ȃ���Ȃ�܂���B���E�I�ɂ�20���~�K�͂Ƃ������Ë@��s��̒��ŁC����10�����߂���{�̈�Ë@��Y�Ƃ�����傫����ĂĂ������߂ɂ��C�l�I�ȑ��ʂƁC�V���Ȏ{��C�d�g�݂̌������̗��ʂ��瑝�����}������C�Ƃ����̂����݂̏ł��B
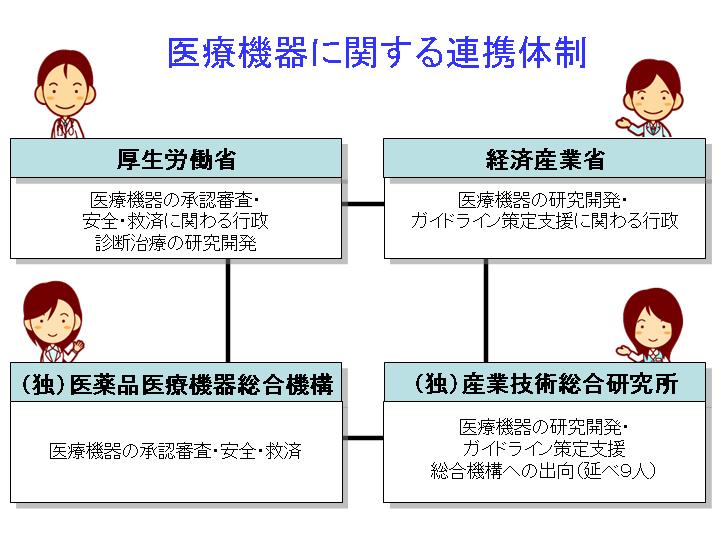
���������{��̈�Ƃ��āC���݁C���i�E��Ë@��̏��F�R���E���S�E�~�ςɊւ���@�ւł���u�Ɨ��s���@�l�@���i��Ë@�푍���@�\�v�i�o�l�c�`�j�ɑ��āC�u�Y�ƋZ�p�����������v������C�R���̎x�����s�����ƂƂȂ�܂����B���N�P�l�ȏオ�o�����C����܂łɂׂ̂X�l���R���ł̋��͂��s���Ă��܂��B���Ȃ݂ɁC���܂�n�C���X�N�i�ł͂Ȃ��C���[�`���ɂ��������ĐR���ł���悤�ȋ@��R�������ԔF�؋@�ւɂ��u��O�ҔF�v�Ƃ��ĐR�������̂ɑ��C�u��b���F�v�Ƃ͔��ɐV�����@��C�܂��ʏ�̊�ɍ��v���Ȃ��������f�o�C�X�Ȃǂɑ��C���i��Ë@�푍���@�\�C�����J���Ȃ��o�ďo����鏳�F�̂��Ƃ��w���܂��B
�܂��C���̒��ɂ͂��߂ďo�Ă����Ë@��͐R��������m���Ȃ��Ƃ������̂ŁC���̂��߂Ɂg��Ë@���R�����邽�߂̃K�C�h���C���h���w��ƌ����J���ȁC�o�ώY�ƏȂ��ꏏ�ɍ��C�����Ƃ����������s�����ƂŁC���̖s�����x������Ƃ������Ƃɂ����͂��Ă��܂��B
�p�D���̋@�ւ̓Ɨ��s���@�l���ɂ���āC�u�R���̃n�[�h����������Ǝv������C�t�ɂ�����Ȃ����v�C�Ƃ̌���������悤�ł����E�E�E�B
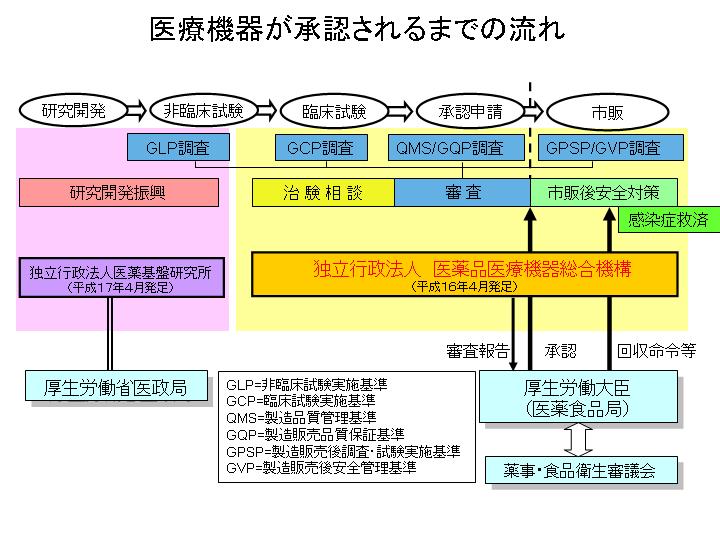
����͂��̋@�ւ��̂��̂ɋN��������̂ł͂Ȃ��C�u�V�@�v�̎{�s�ɂ��Ƃ��낪�傫���ł��傤�B���Ȃ݂ɂ��̋@�ւ͕���16�N�ɂł��܂������C�V�@�͕���17�N�S���Ɏ{�s����C��������̐����傫���ς��C�ƊE�ĕ҂ɂȂ����Ă������Ƃ������Ƃ������܂��B
��Ë@��̊J���v���Z�X�͂����m�̂Ƃ���C�@��w����ь������ł̊�b�����C�A�������ł̎����⓮�������Ȃǂɂ��u��Տ������v�C�B�l�ɑ��čs����u�Տ������v���o�ăf�[�^�𑵂��C���F�\�����s���C�P�N�`�Q�N�̎��Ԃ������ď��F��Ɏs�́C�Ƃ�������ɂȂ�܂��B
�����������F�܂ł̈�A�̗���ɂ��āC���@�ł͂��܂�ׂ����K��͂���܂���ł������C����17�N�S�����K�p���ꂽ�V�@�ł́C�A�����J�ł��K�p����Ă���u�f�k�o�i�O�b�h�E���{���g���[�E�v���N�e�B�X�j�v�u�f�b�o�i�O�b�h�E�N���j�J���E�v���N�e�B�X�j�v�u�p�l�r�i�N�I���e�B�E�}�l�W�����g�E�V�X�e���j�Ƃ����h�r�n�̃��[�����C�K�p����邱�ƂɂȂ��Ă��܂��܂����B
���������ω��́C�N��1000���ȏ�̊�Ƃ�������ƌ���A�˂鐻��̐��E�ƈ���āC�x���`���[��Ƃ������C������Ƃ��l��s���̒��Ńo���G�e�B�ɕx�@�������Ă����Ë@��Y�ƂɂƂ��ẮC�傫�ȕ��S�Ƃ��킴��܂���B
�Ƃ͂����C�R���ɓ������Ă͈��S�E���S�Ƃ����ϓ_�ŁC�u�����h�r�n���[���̏������������Ƃ���オ���Ă����Č��ł��邱�Ɓv�����Ă��邩�ǂ������܂��ŏ��Ɋm�F����܂��̂ŁC�Ή��͕K�{�ł��B���̏�ł��Ȃ�̕��������ސR���ɂ���čs���܂��B�͗��Ă���̌��܂��Ă���C���[�`���Ɋ�Â��āi����A�u�X�g���N�g�ƌ��_�����āj�C���ɂ���ɂӂ��킵���菇�ŁC���@�_�Ǝ������ʂ������Ă��邩�C�Ƃ��������Ƃ����Ă�����ƂɂȂ�܂��̂ŁC���ނ̗ʂ�����Ë@��R���̂ق����͂邩�ɖc��ł����C�g����g�_���̍��ǁh�ƂقƂ�Ǔ����悤�Ȃ��̂��Ƃ������Ƃ��ł��܂��B
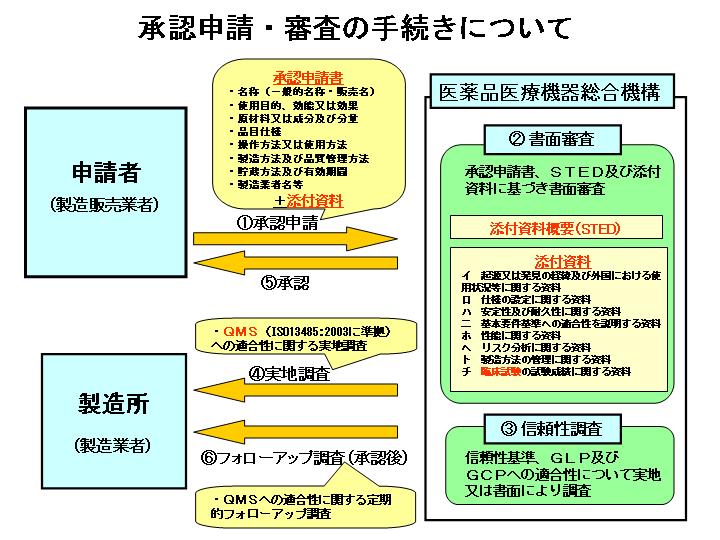
���{�I�ɂ���ė��@���́g�@�h�i�i���C�L��������ш��S���̊m�ۂ̂��߂ɕK�v�ȋK�����s���j�ŁC���i�C��Ë@��C���ϕi�Ȃǂ����̐R���̑ΏۂƂȂ�܂��B
Q�D�Ȃ����i�ɂ͑��Ƃ������C��Ë@��ɂ͏����Ȋ�ƁC�x���`���[�������̂ł����H
��Ë@��́C���Ƃ��Ύ�p�p���̎g�p�ړI��ύX���������ł��C����͂����g�ʂ̈�Ë@��h�ɂȂ��Ă��܂��܂��B�\���͕i�ڂ��Ƃɍs�����̂Ȃ̂ŁC�i�ڂ��ς������C���������\��������܂���B�܂��C����Ă��鑤���u�����̏��i�͂���v�Ƃ����ӎ������m�ŁC���Ƃ������q���ޗ��Ƃ����Ђ͋����Ȃǂق��̍ޗ��ł͍��Ȃ����C�����ō���Ă���Ƃ���͋����̂��̂�������܂��B�܂��d�C�̓��ӂȂƂ���͓d�C�V�X�e���������܂��B
���ׂĂ̊�Ƃ��W�F�l�����X�g�ł���C�����炭���ЂŃJ�o�[�ł���̂ł����C��͂�H�w�ɂ����邻�ꂼ��̓��ӕ�����������āC�Ƃ���������C���݂̂悤�ȋƑԂɂȂ�̂��Ǝv���܂��B���������҂Ƃ��Ċւ���Ă���g�l�H�S���h�Ȃǂ́C�ގ��ł���`�^�������H�ł����Ƃ͌����Ă��܂����C�`�^�����ƍŌ�̕\�ʌ������T�u�~�N�����łł��邩�Ƃ������Ƃ���Ԃ̋Z�p�͂̍��ɂȂ��Ă��܂��B���̂悤�ɁC�g1�̋Z�p���E���ɂ���h�ƂȂ�ƁC���i��Y�ł����Ƃ͏��Ȃ��ł����C������Ƃ�����Ă������1��1���C�\���ł���f�o�C�X�ɂȂ��Ă����Ƃ������Ƃł��B
�|�Ǝ��̃V�X�e���ŁC�Q�N�߂��������Ă����R�������ĕ��݂�14�����Ɂ|
�p�D��̓I�ɁC����܂ł̈�Ë@��R���̗���͂ǂ̂悤�ɂȂ��Ă����̂ł��傤���H
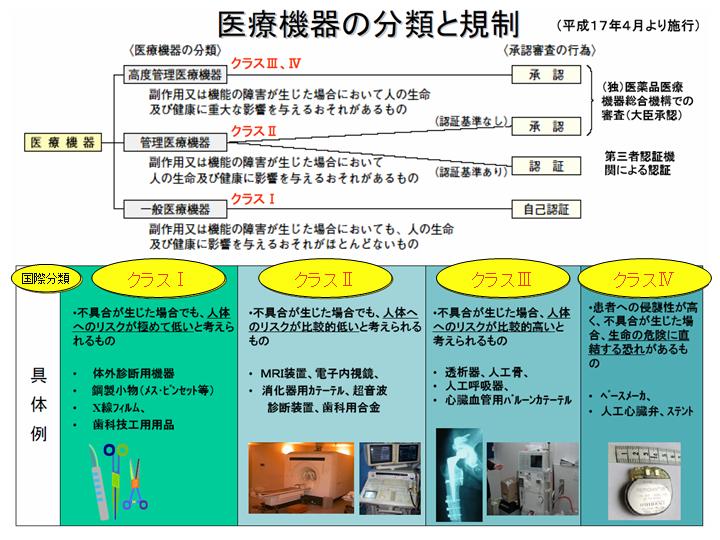
��Ë@��ɂ̓��X�N�ɉ����āC�������̃N���X������܂��B
�܂��C�̉��v�̂悤�ɐl�̂ւ̃��X�N������߂ĒႭ�C���ȔF�̂��́i��ʈ�Ë@��F�N���X1�j��C�u�̂ɂ͐G��Ȃ����ǐf�f���ł��܂��v�Ƃ������悤�Ȃ��̂ȂǁC�l�̂ւ̉e�����Ⴂ���́i�Ǘ���Ë@��F�N���X2�j�́C�ق��ɂ��ގ��i�������ĔF�؊�ʒm�̋@�\�����Ȃ��Ƃ������ƂɂȂ�����C���Ԃ̔F�ؒc�̂̂ق��ɂ܂��܂��B�u�ق��ɂ͗ގ��i���Ȃ��C�F�؊�ʒm�ɂȂ��@�\��L����@��v�Ƃ����Ƃ��ɁC��Ë@�푍���@�\�̂ق��ɉ���Ă���킯�ł��B�N���X�R�`�S�́C�l�̂ւ̉e��������߂č������̂�C�N�P�I�ɖ��ߍ���Ƃ������n�C���X�N�i�̏ꍇ�ɂ��C���i��Ë@�푍���@�\���o�đ�b���F�Ƃ������ƂɂȂ�܂��B
���ނ́u�\�����v�u�Y�t�����v�u�Y�t�����T�v�v�̂R�_���Z�b�g�Ƃ��Ē�o���Ă��炢�C����܂ł͊T���ĂQ�N�߂��������ĐR�����Ă��܂����B���ۂ̐R���̗���ɂ��ẮC�}�����Ă����������ق����킩��₷�����Ǝv���܂����C���M���ׂ��_�Ƃ��āu�Տ��������K�v���H�v�Ƃ������Ȃǂ́C�R���̒��ł悭�c�_�ɏ��܂��B
�u�C�O�ł��g�p���Ⴊ�Ȃ��C�����߂āv�Ƃ����ꍇ�ɂ́C���R�Տ������͕K�v�ł��B�������u�C�O�ʼn��Ⴉ�g�p���Ⴊ���邪�C���{�Ŏg���̂͏��߂āv�Ƃ����ꍇ�ɂ́C�c�_��������Ă��܂��B�������Տ������f�[�^�͊C�O�̂��̂������̂��̂���ʂ����ɏo���܂����C���ƈ�Ë@��ł́C�u����l��ɂ���đ̂̑傫�����Ⴄ�̂ɁC��ʂȂ��g����̂��H�v�Ƃ����@�������̂ŁC���{�Ő��Ⴞ���ł��Տ��������s���āC���Ƃ͊C�O�̑����̃f�[�^���Q�Ƃ���C�Ƃ����u���킹�Z�v��K�p����ꍇ������܂��B
�܂��C���{�S���ł��N�Ԑ��Ⴕ�����ڂɂ�����Ȃ��悤�ȁu���a�v�Ɋւ���@��̏ꍇ�ɂ́C�ߋ��̘_�������āC���E���J���Ńf�[�^���W�߂ĉ�͂��܂����v�Ƃ����悤�ȁu�Տ��]�����v�Ƃ������̂őΉ�����ꍇ������܂��B
�p�D�ŋ߁C���F�܂ł̎��ԒZ�k�̂��߂ɁC�������̑̂��Ă���悤�ł����B
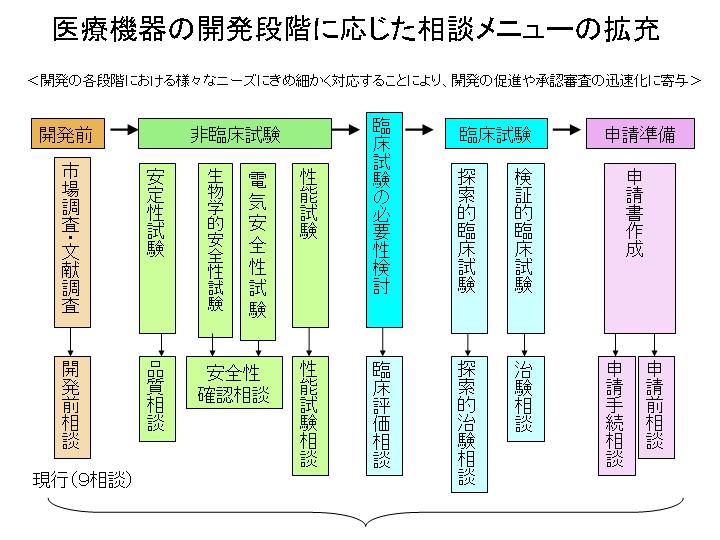
�ŋ߂̓����ɂ��ď����b������ƁC�܂����̃|�C���g�Ƃ��āC�u���k�v�Ƃ������̂��g�[���Ă��܂��B�Ȃ��Ȃ�C�g�����\���̒i�K�ŏ��ނ̗ǂ����������ɂȂ�C���������ƑS���������C�Ȃ�Ă��Ƃ����Ă��ẮC�傫�Ȏ��Ԃ̃��X�ɂȂ邩��ł��B�ȑO�ɂ��ꕔ�ɖ������k�Ȃǂ�����ɂ͂������̂ł����C�R�����e�Ɋւ��鑊�k�͂���܂���ł����B���������F�܂ł̎��ԒZ�k�̂��߂ɂ́C�R���O�ɂ����ɐR���ɕK�v�ȃf�[�^���������邩���d�v�ŁA���̈Ӗ��ł����̎��O���k�͕K�{�̗v�f�Ƃ����܂��B
���Ƃ��u��Տ������i�������̎����C���������j�͂���ł悢�̂��낤���v�C�u�Տ������͂ǂ̂悤�ɐv���Ă����悢���v�C�u�R�O��̎���������̂��C�U�O��̎���������̂��v�Ƃ����^��ɑ����j���[�Ŏ�����������K�ȑ��k���s���C������x�̍��ӂ��ł��Ă���C���Ȃ��Ƃ��\���̃X�^�[�g���C���ł܂Â����Ƃ͂���܂���B�ł��邾�����߂ɑ��k�����āC�����\�����ނ��o�Ă�����C����ȍ~�͐������ŏ����������悤�C�Ƃ��������Ɍ������Ă��܂��B�܂��R���̈�ʘ_�ɂ��đ��k����C�����̎��O���k�Ƃ������̂�����܂��B
�ŋ߂͑O�|���ő��k�����Ă��āC�\�����ނ������Ă���ꂽ���ɂ́u�i�@�\�̂ق��ł��C�j���̓��e�Ȃ�����m���Ă����v�Ƃ�����Ԃɋ߂Â��悤�Ɠw�͂��Ă��܂��B
����̑��k�̊g�[�́C���F�܂ł̎��ԒZ�k��ړI�Ɏn�܂����C�u�A�N�V�����v���O�����v�̈�ł��B�����2009�N�̂S������X�^�[�g����5�N�v���W�F�N�g�ŁC�J�����Ԃ�12�����C�R�����Ԃ��V�����C���v��19�����Z�k����B�܂肱��ɂ���āC�A�����J���݂́u14�����ŏ��F�v�ɂ����Ă������Ƃ��_���ł��B���̂��߂̕���Ƃ��āC�N�X14���Â̗p���s���C�l����35������104���ւƂR�{���ɂ���v�悪���N�x��������i��ł��܂��B
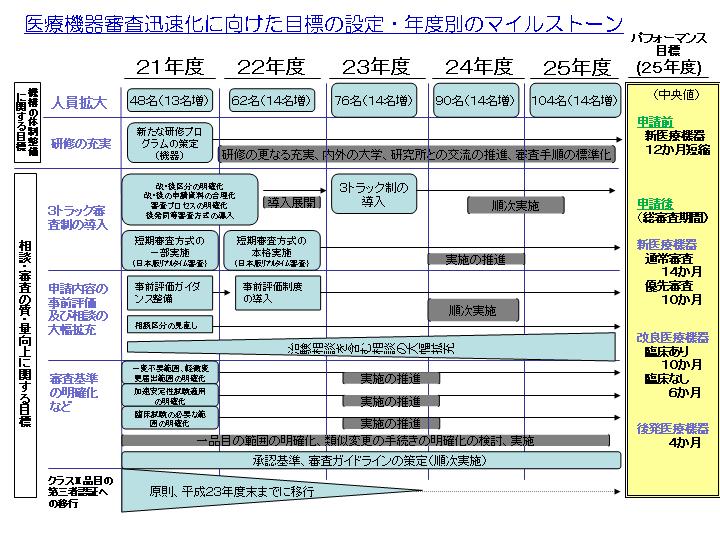
�܂��C���́u�A�N�V�����v���O�����v�̒��̔��ɓ����I�Ȏ��g�݂Ƃ��āC�R���Ώۂ��u�V��Ë@��v�u���Lj�Ë@��v�u�㔭��Ë@��v��3�ɋ敪���āu�R�g���b�N���v���������ꂽ���Ƃ��������܂��B
���Ƃ��C��������炷�ׂĂ������R���̗�ɕ���ł����Ƃ�����C�u�R������C�����ɏI���v�悤�Ȑl�������C���N���҂��Ȃ�������Ȃ��悤�ȏɂȂ��Ă��܂��܂��B�����ŁC�������H�ŏa��������邽�߂ɁC�ᑬ�Ԑ���ǂ��z���Ԑ��Ȃǂ�����悤�ɁC�R���Ώۂ��R�ɕ����C�R���̊ȒP�ȕi�ڂ͂ǂ�ǂ������āC�R���̑�ςȂ��̂͂�������ƐR��������C�Ƃ������@�ɂ����̂ł��B
�@3�g���b�N���ɂ��R�����Ԃ��ڕW�����߂��Ă��āC����܂łɂ܂�������̂Ȃ��悤�ȐV��Ë@��̏ꍇ�C���Ă�20�`22�����������Ă��܂������A���������V��Ë@��ł����Ă��C5�N��ɂ́C��������14�����ŐR������������悤�ɂ��悤�Ƃ��Ă��܂��B
Q�D2�N�߂��������Ă����R�����P�S�����ŁC�Ƃ����̂́C���I�Ƃ���������ԒZ�k�ł��ˁB
�͂��B�����ɃA�����J�ł�14�����قǂŏ��F����Ă���킯�ł�����C���E�I�Ȏs�ꋣ�����l����Ƃ��̂��炢�̖ڕW�ݒ�͕K�v�ł��B�A�����J�Ɠ��{�ł́C��Ë@��ɑ���@���x���傫���قȂ�܂��̂ŁC�A�����J�̎d�g�݂����̂܂Q�l�ɂ���Ƃ����킯�ɂ͂������C�����܂œ��{�Ǝ��̎d�g�݂ƂȂ��Ă��܂����C�����̎d�g�݂ŏ[���B���\�ȖڕW�ł���Ƃ��l���Ă��܂��B
�E�E�E�Ƃ͂����܂��Ă��C����́u�ߋ��ɐ\�����ꂽ���́v�����������ς܂�Ă���B�܂���������ʂ菈�����Ă��܂��܂ł́C�V���Ȋ��ԒZ�k�̎��g�݂ɂ�����܂���B���̂��߁C����܂ł̂��̂���x�S���Ȃ��Ȃ�R�N������h�ɁC����琔�l�ڕW���������Ă��������ƍl���Ă��܂��B
�������ߋ��̑؉݂��Еt���܂ő҂��Ă������������̒��ł��C�D��I�ɐR�����s������̂�����������܂��B�u�D��R���v�ƌĂ�邱���̐R���i�ڂ́C�w��w�肷��u��Ãj�[�Y�̍�����Ë@��v�̈ꕔ��C�u���a��Ë@��v�Ȃǂ�����ɓ�����܂��B�����͂R�g���b�N�����{�i�^�p���ꂽ����C�R�g���b�N�̘g�̊O�ŁC�v���ȐR�����s���܂��B
�������ߋ��̑؉݂��Еt���܂ő҂��Ă������������̒��ł��C�D��I�ɐR�����s������̂�����������܂��B�u�D��R���v�ƌĂ�邱���̐R���i�ڂ́C�w��w�肷��u��Ãj�[�Y�̍�����Ë@��v�̈ꕔ��C�u���a��Ë@��v�Ȃǂ�����ɓ�����܂��B�����͂R�g���b�N�����{�i�^�p���ꂽ����C�R�g���b�N�̘g�̊O�ŁC�v���ȐR�����s���܂��B
�Ō�ɁC����͎d�g�݂Ƃ͊W�Ȃ��̂ł����C���i��Ë@�푍���@�\�̑̎����̂��C����܂łƂ͑傫���ς���Ă����悤�Ɏv���܂��B��Ƃ̐l����u�ŋ߁C�����@�\�͌h����g���悤�ɂȂ��Ă����v�ȂǂƏ�k�߂����Ă����܂����i�j�C�̂̂悤�ȁu�ォ��ڐ��v�ł͂Ȃ��C��������̖ڐ��ŋc�_���s����悤�ɂȂ��Ă����Ƃ����͔̂��Ɋ����܂��B�܂������@�\�̐l���z�u���C���ʂ̐R�����̂ق��ɁC��t�̎��i���������l�X������C�Տ�����̃t�B�[�h�o�b�N������܂��B����Ɏ��̂悤�ȃG���W�j�A���Q���������Ƃɂ���āC������x��Ë@��̊J���Ɍg������G���W�j�A�����O����̃t�B�[�h�o�b�N���C�����s����悤�ɂȂ��Ă��܂����B
������C�v���ȐR���Ɍ����āC�������̎��݂����{���Ă��܂��̂ŁC�����������ɂ��ڂ������C�܂��͋C�y�ɑ��k�ɗ��Ă����������Ƃ��C���F�܂ł̈�Ԃ̋ߓ����Ƃ����C�����Ă��܂��B
�\�\�@���肪�Ƃ��������܂����B
(��ނ����ƂɁu�w�ۃl�b�g���[�N�v�ݗ�������L���쐬�j
![]()
�{�����ւ̂��ӌ��C�����₪����܂�����C���Ђ����������B�������ɂĂ��҂����Ă���܂��B